Khí hiếm, hay còn được gọi là khí trơ thuật ngữ chung dùng để chỉ các nguyên tố thuộc nhóm 18 trong bảng tuần hoàn hóa học. Chúng được gọi là khí hiếm hoặc khí trơ vì chúng không tham gia vào bất kỳ phản ứng hóa học nào. Tuy nhiên, có một sự không chắc chắn về việc nguyên tố có số nguyên tử là 118, được gọi là Oganesson, có thể không phải là khí hiếm.
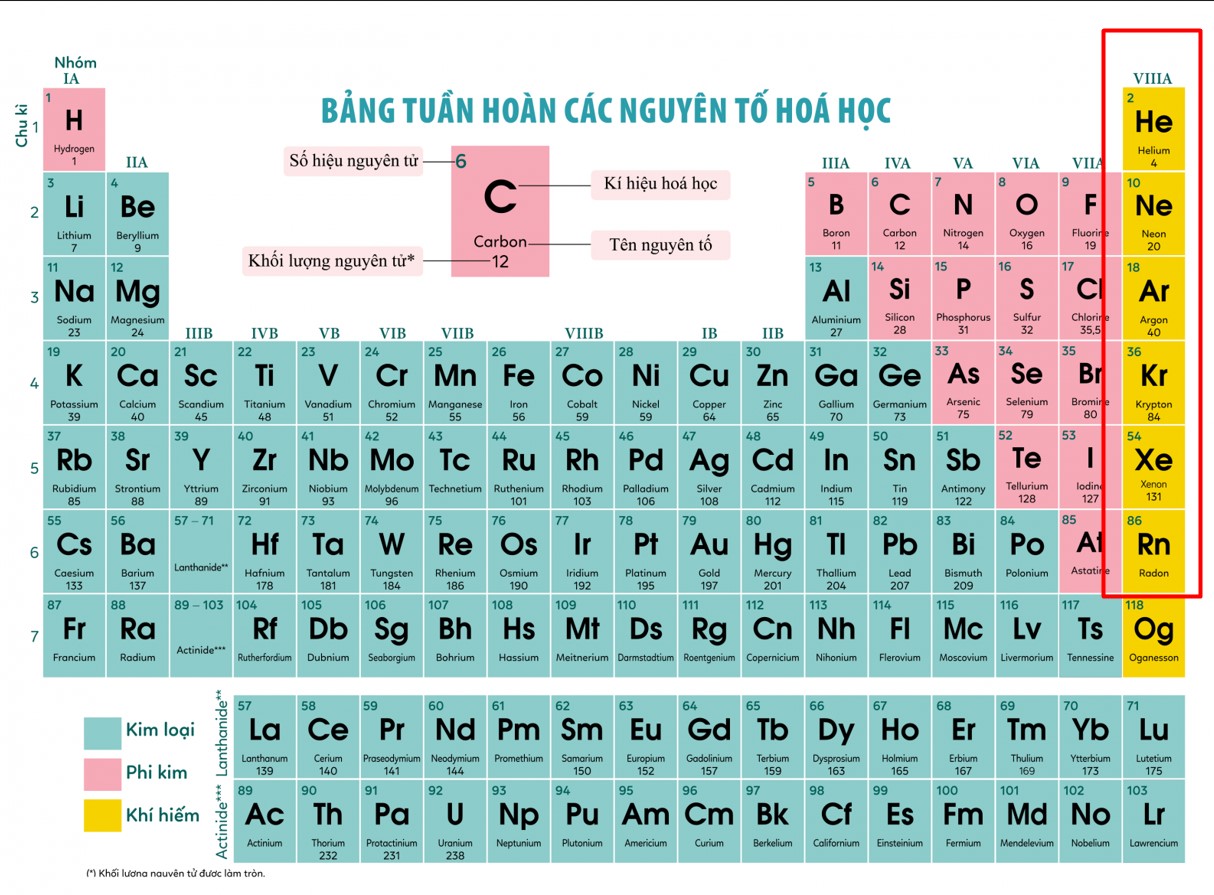
Trên bảng tuần hoàn, nhóm khí hiếm bao gồm Heli, Neon, Argon, Krypton, Xenon, Radon và có thể Oganesson. Các nguyên tố này được phát hiện khá muộn do tính chất hoạt động hóa học thấp. Chẳng hạn, Heli chỉ được phát hiện vào năm 1868 trong quang phổ mặt trời, trong khi Radon được tạo ra trong chuỗi phân rã của Uranium và phát hiện vào năm 1900.
Đặc điểm của khí hiếm
Cấu trúc electron của các nguyên tố khí hiếm cho thấy rằng chúng có lớp ngoài cùng đều có 8 electron, trừ Heli có 2 electron. Do không có khuynh hướng nhận hoặc nhường electron để tạo ra cấu trúc ổn định 8 electron, các khí hiếm không hoạt động hóa học. Tuy nhiên, dưới điều kiện đặc biệt, chúng vẫn có thể tham gia vào các phản ứng hóa học.
-
Tồn tại dưới dạng chất khí, không mùi, không màu và không vị. Ở điều kiện tiêu chuẩn, chúng không bắt lửa và không cháy.
-
Trong điều kiện thông thường, phần lớn các loại khí trơ không phản ứng với các nguyên tố khác, trừ những trường hợp đặc biệt. Điều này là do cấu trúc nguyên tử của chúng có vỏ ngoài gần như đầy đủ electron hóa trị, giảm khả năng tham gia vào các phản ứng hóa học.
-
Trong một số điều kiện đặc biệt, chúng có thể chuyển sang các màu sắc khác nhau hoặc trạng thái lỏng và rắn.
-
Có khả năng oxy hóa cực thấp, gần như không có.
-
Khá trơ trong các phản ứng hóa học.
-
Năng lượng ion hóa cao.
-
Không gây cháy.
-
Vỏ electron hóa trị và tổng số electron bên ngoài đều bằng 0.
-
Các loại khí trơ có nhiệt độ nóng chảy và nhiệt độ sôi gần nhau, chênh lệch không đáng kể, chỉ khoảng 10 độ C. Dưới điều kiện nhiệt độ thấp, chúng tồn tại dưới dạng chất lỏng.
|
Tên nguyên tố |
Ký hiệu hóa học |
Số hiệu nguyên tử |
Cấu hình e |
Nhiệt độ sôi (độ C) |
Nhiệt độ nóng chảy (độ C) |
|
Heli |
He |
2 |
1s2 |
−268,83 |
–272,00 |
|
Neon |
Ne |
10 |
1s22s22p6 |
−245,92 |
−248,52 |
|
Argon |
Ar |
18 |
[Ne]3s23p6 |
−185,81 |
−189,60 |
|
Krypton |
Kr |
36 |
[Ar]3d104s24p6 |
−151,70 |
−157,00 |
|
Xenon |
Xe |
54 |
[Kr]4d105s25p6 |
−106,60 |
−111,50 |
|
Radon |
Rn |
86 |
[Xe]4f145d106s26p6 |
−62,00 |
−71,00 |
Ứng dụng của khí trơ trong sản xuất và đời sống
- Heli: Sử dụng trong thổi bóng bay, bình dưỡng khí cho thợ lặn sâu, điều trị hen suyễn, hàn kim loại.
- Neon: Sử dụng trong đèn quảng cáo, laser, làm lạnh trong công nghiệp.
- Argon: Sử dụng trong bóng đèn dây tóc, hàn kim loại, làm bảo vệ trong sản xuất titan và chất bán dẫn.
- Krypton: Sử dụng trong laser fluorua krypton.
- Xenon: Sử dụng trong đèn chớp của máy ảnh, trong y học là chất gây mê toàn phần và trong nghiên cứu vật lý hạt nhân.
Khí hiếm có nhiều ứng dụng quan trọng, nhưng nguồn cung hiện đang giảm dần. Việc sử dụng và tiết kiệm khí hiếm một cách hiệu quả là điều cần thiết để bảo vệ môi trường và nguồn tài nguyên.


